제도소개
첨단재생의료 임상연구 지원
중대한 질환 및 희귀질환 등 의료적 필요성이 높은
첨단재생의료 임상연구를 지원합니다.
첨단재생의료 임상연구
주요내용
임상연구계획 심의 및 진행
첨단재생의료란?
(「첨단재생바이오법」 제2조 제1호)
사람의 신체 구조 또는 기능을 재생, 회복 또는 형성하거나 질병을 치료 또는 예방하기 위하여 인체세포등을 이용하여 실시하는 세포치료, 유전자치료, 조직공학치료 등을 말한다.
다만, 세포·조직을 생물학적 특성이 유지되는 범위에서 단분분리, 세척, 냉동, 해동 등의 최소한의 조작을 통하여 시술하는 것은 제외*한다.
-

인체세포등을 이용하여
재생, 회복, 대체 -

-

손상된 신체 기능
또는 구조 -

-

질병치료
또는 예방
「첨단재생바이오법」 적용 제외대상
- 「국민건강보험법」 제41조제4항에 따른 비급여 대상
미용·성형 목적 시술 - 첨단재생의료 및 첨단바이오의약품 정책심의위원회 심의를 거쳐 보건복지부장관이 고시하는 시술
첨단재생의료의 범위
-
세포 치료 Cell therapy
사람 또는 동물로부터 유래한 세포를 이용하여 사람을 대상으로 하는 치료
-
유전자 치료 Gene therapy
유전물질을 인체로 전달하거나 유전물질이 변형·도입된 사람
또는 동물의 세포를 인체로 전달하는 치료 -
조직공학 치료 Tissue engineering therapy
조직의 재생, 복원 또는 대체 등을 목적으로 사람 또는 동물로부터
유래한 세포나 조직에 공학 기술을 적용하여 사람을 대상으로 하는 치료
-
융복합 치료 Convergence therapy
다음 중 어느 하나에 해당하는 치료
- 세포, 유전자 및 조직공학치료 중 둘 이상을 혼합한 치료
- 세포, 유전자 및 조직공학치료와, 이 중 둘 이상을 혼합한 치료 중
어느 하나에 「의료기기법」 제2조제1항에 따른 의료기기를 물리적·화학적으로 결합(융합, 복합, 조합 등을 포함한다)한 치료로써 사람을 대상으로 하는 치료
첨단재생의료에 사용하는 인체세포등의 범위
- 사람 또는 동물로부터 유래한 세포·조직 또는 이를 조작, 가공 및 제작 등 물리적·생물학적 방법으로 처리한 것
- 동물의 장기 또는 이를 조작, 가공 및 제작 등 물리적·화학적·생물학적 방법으로 처리한 것
- 그 밖에 제1호 또는 제2호에 따른 세포·조직 또는 장기 등을 활용한 것으로서 법 제13조제1항에 따른 첨단재생의료 및
첨단바이오의약품 심의위원회(이하"심의위원회"라 한다)의 심의를 거쳐 보건복지부장관이 식품약품안전처장과 협의하여 고시하는 것
첨단재생의료 임상연구 위험도 구분
-
고위험
사람의 생명 및 건강에 미치는 영향이 불확실하거나 그 위험도가 큰 임상연구
- 배아줄기세포, 역분화줄기세포를 이용하는 연구
- 동물의 세포를 이용하는 연구
- 다른 사람으로부터 유래한 세포(배아줄기세포 및 역분화줄기세포는 제외한다)를 이용하는 연구.
※ 다만, 세포를 단순분리, 세척, 냉동, 해동하는 등 최소한으로 조작(이하"최소조작"이라한다)하여 이용하는 경우는 제외한다. - 유전자를 이용하는 연구
- 신체 기능의 완전 대체를 목적으로 인공 조직 또는 장기를 이용하는 연구
-
중위험
사람의 생명 및 건강에 부정적인 영향을 미칠 우려가 있어 상당한 주의를 요하는 임상연구
- 연구대상자 본인으로부터 유래한 세포(배아줄기세포 및 역분화줄기세포는 제외한다)를 이용하는 연구. 다만, 세포를 최소조작하여 이용하는 경우는 제외한다.
- 다른 사람으로부터 유래한 세포(배아줄기세포 및 역분화줄기세포는 제외한다)를 최소조작하여 이용하는 연구
- 신체 기능의 구조적 복원을 목적으로 인공 조작 또는 장기를 이용하는 연구
-
저위험
사람의 생명 및 건강에 미치는 영향이 잘 알려져 있고 그 위험도가 미미한 임상연구
- 연구대상자 본인으로부터 유래한 세포(배아줄기세포 및 역분화줄기세포는 제외한다)를 최소조작하여 이용하는 연구
- 중위험에 해당하는 연구 중 충분한 연구자료의 축적 등으로 안전성이 증명된 연구로서 심의위원회 심의를 거쳐 보건복지부장관이 고시하는 연구
첨단재생의료의 범위
첨단재생의료 임상연구 지원의 필요성
-
01
기존 의약품 관리제도나 신의료기술제도는 첨단재생의료의 특성을 반영하지 못하고 있어 실제 임상연구로 진입하는데 한계가 존재
-
02
재생의료는 살아있는(가변성) 세포를 이용하는 특성상 실제 인체에 투여하여야 효과성과 안정성을 확인할 수 있으므로
사람을 대상으로 하는 임상연구가 제품화로 가는 가장 중요한 절차라고 할 수 있음 -
03
「첨단재생바이오법」을 통해 국가가 직접 첨단재생의료 임상연구를 지원하고 안전관리를 수행함으로써 공익목적의 기술개발 활성화

치료기회 제공
첨단재생의료 임상연구 지원내용
-

R&D 지원
- 재정 부담 완화 및 다양한 연구기회 확보
- 임상연구 수행에 수반되는 의료행위에 대한 보험수가 적용
-

첨단재생의료 특성에 맞춘 심의
- 재생의료 환경에 맞춘 심의 및 연구관리
-

국가 주도 안전관리
- 사용자 부담 완화
- 국민의 안전 확보
첨단재생의료 임상연구 지원의 필요성
-
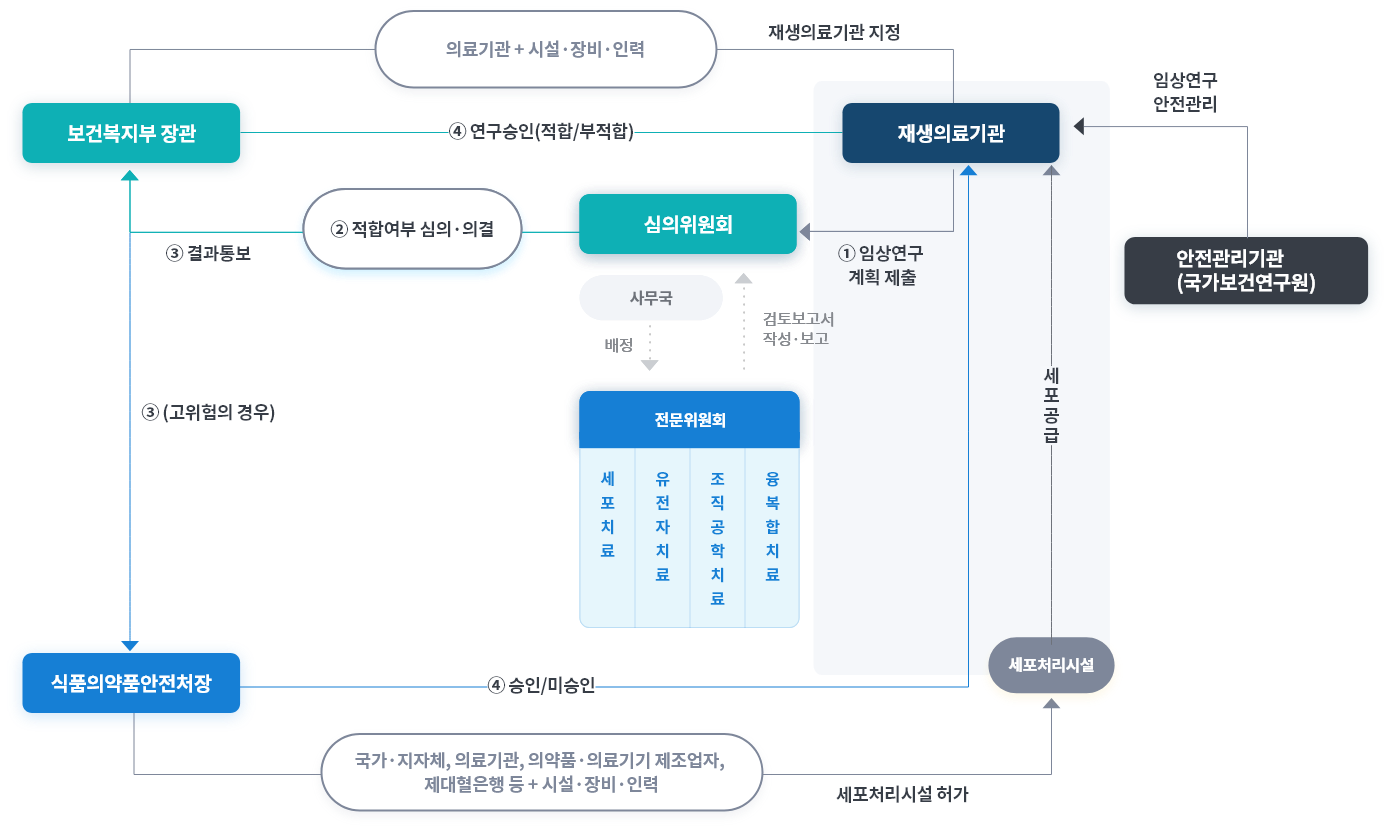
01
재생의료기관 지정
첨단재생의료 임상연구를 진행하고자 하는 자(「의료법」 제3조에 따른 의료기관)는 「첨단재생바이오법」에 따라
보건복지부장관으로부터 첨단재생의료실시기관으로 지정 받아야 함 -
02
첨단재생의료 임상연구계획 심의 신청
첨단재생의료실시기관이 첨단재생의료 및 첨단바이오의약품 심의위원회에 임상연구계획 심의 신청
-
03
사무국 접수 및 전문위원회 검토보고서 작성
전문위원회는 심의위원회에 검토보고서를 보고하고, 심의위원회는 임상연구 적합여부 결정(연구의 위험도, 수행내용, 안전관리, 장기추적조사 여부 등 결정 가능)
-
04
첨단재생의료 임상연구 승인 통보
심의위원회의 심의·의결을 거쳐 보건복지부 또는 식품의약품안전처의 최종 승인 통보를 받은 후 임상연구 시작, 연구자는 승인 받은 임상연구계획서를
첨단재생의료 안전관리정보시스템에 등록 -
05
임상연구 수행 및 안전관리
연구자는 연구대상자 등록, 증례기록, 이상반응 등을 안전관리정보시스템을 통해 보고하고, 안전관리기관은 안전성모니터링 수행
-
06
연구 종료 결과 보고 제출
-
07
장기추적조사
