제도소개
첨단재생의료 임상연구 및 치료
중대한 질환 및 희귀질환 등 의료적 필요성이 높은
첨단재생의료 임상연구를 지원합니다.
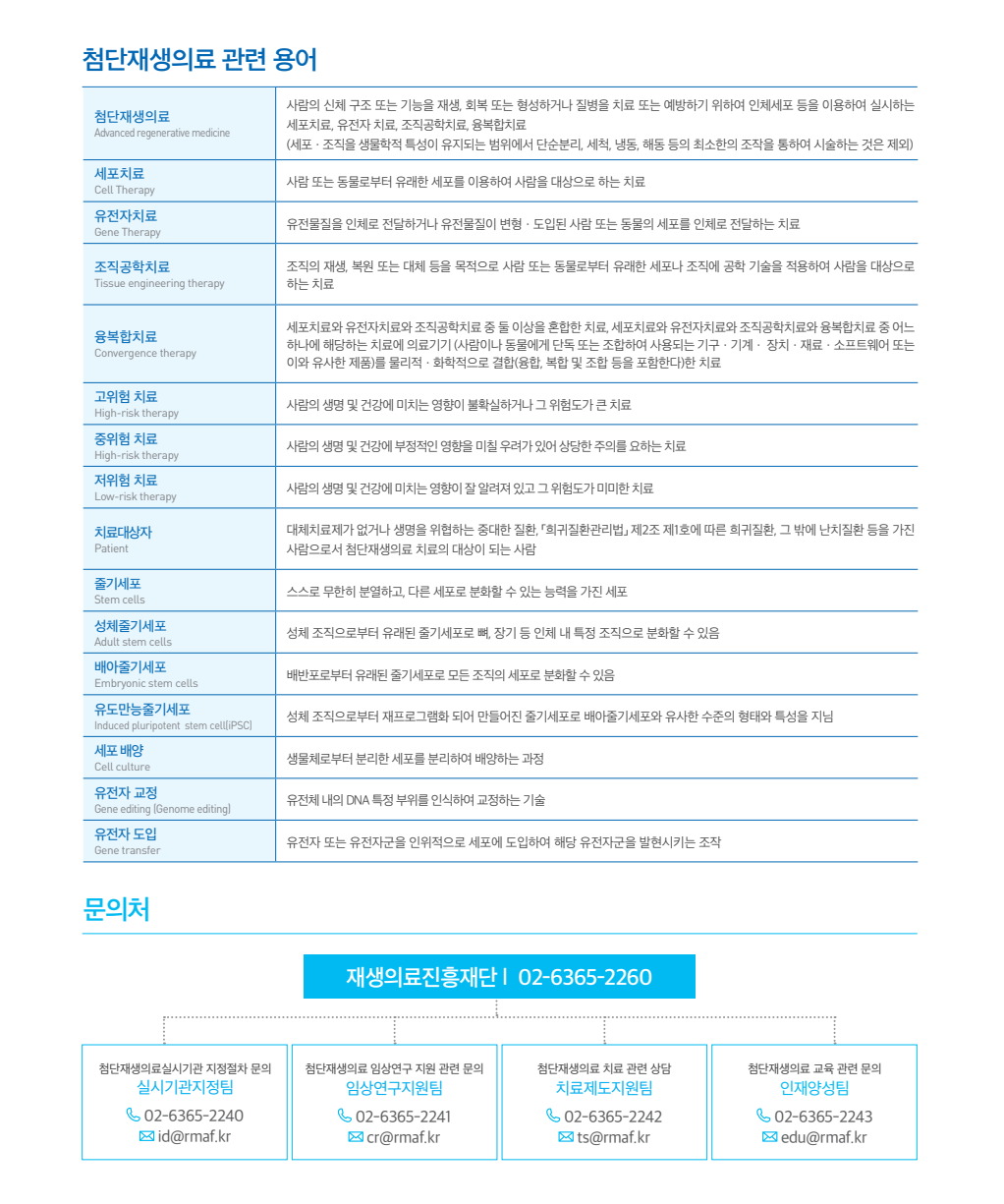
첨단재생의료 개요
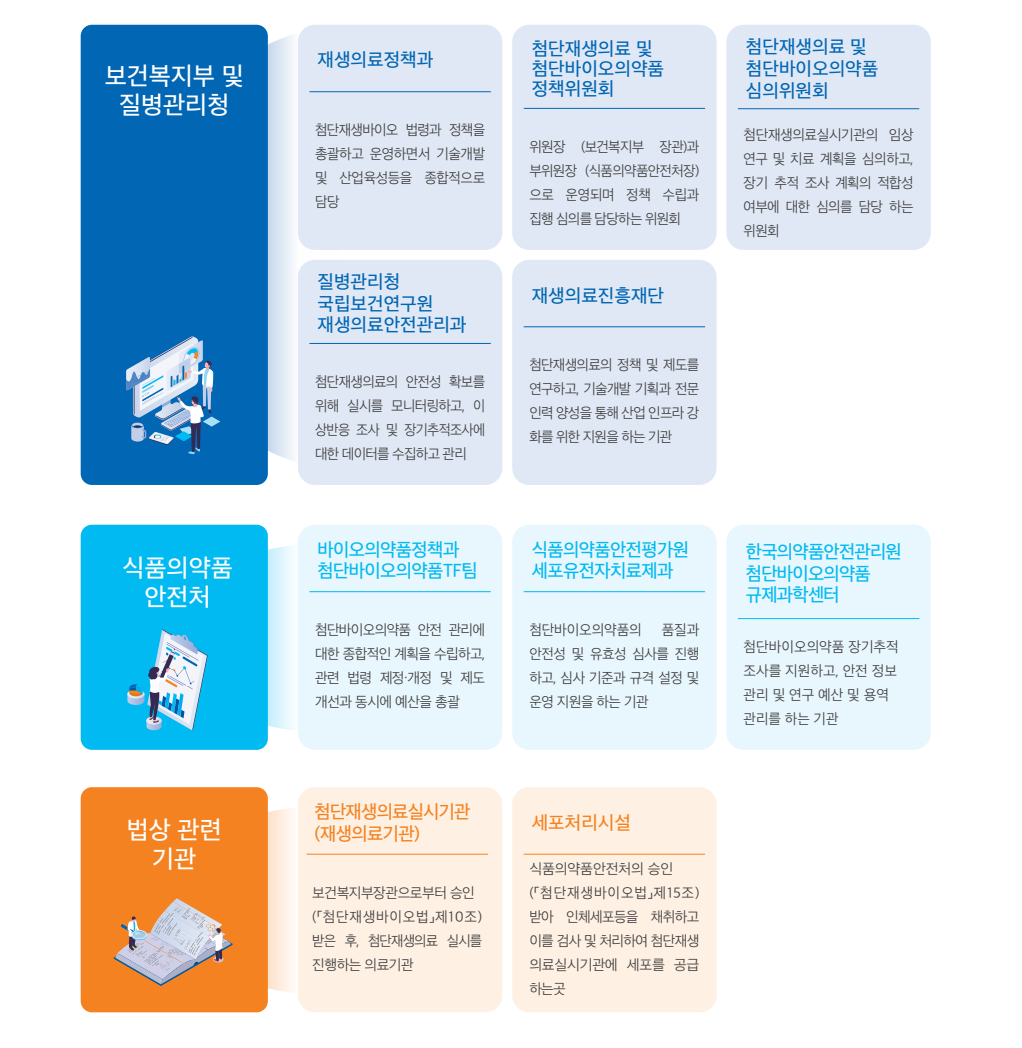
첨단재생의료 관리 체계
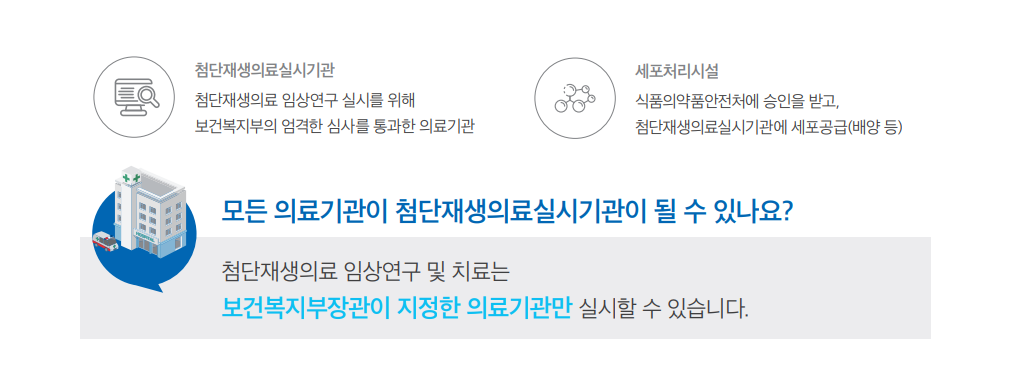
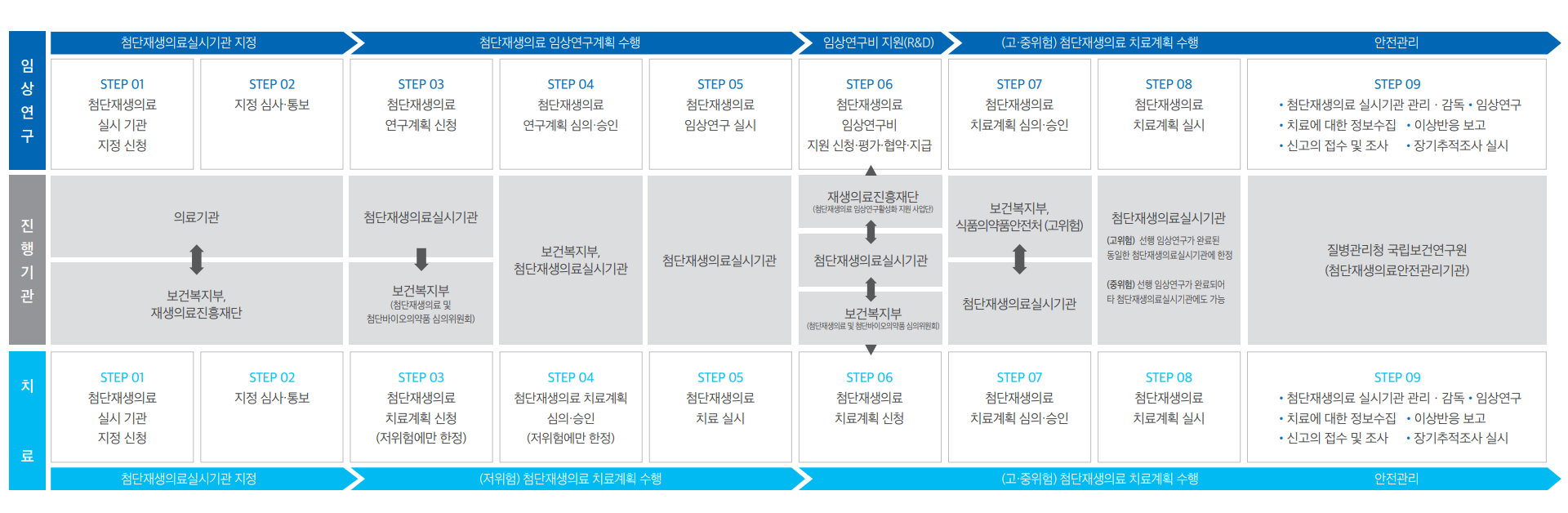
임상연구 및 치료 절차
첨단재생의료 정보
첨단재생의료는 무엇일까?
손상된 인체세포나 조직·장기를 본인의 세포를 배양해서 대체하거나 재생하여 정상적인 기능을 할 수 있도록 회복시키는 의료기술
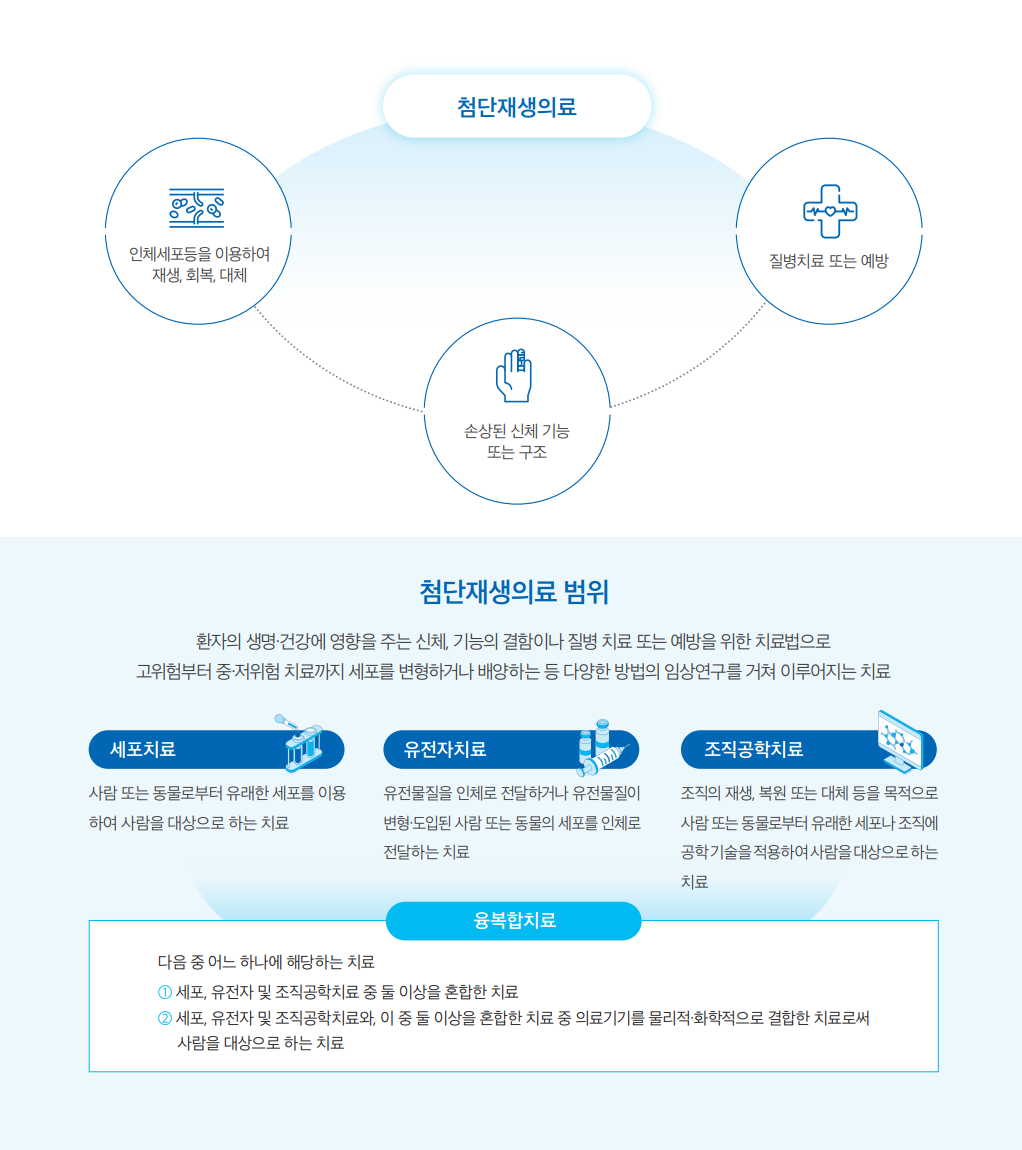

첨단재생의료 관련 기관은 어떤 역할을 수행하고 있을까?
첨단재생의료는 보다 밝은 의료 미래를 위해 분야별 전문가들로 업무 체계를 수립하여 운영하고 있습니다.
첨단재생의료실시기관의 임상연구·치료 절차

알면 유용한 첨단재생의료 정보